肌细胞的收缩
人体的肌组织可分为骨骼肌、心肌和平滑肌三类,其中骨骼肌和心肌在光学显微镜下显现明暗交替的横纹,故统称为横纹肌。
另外,依据所受神经支配和控制的差异,肌组织又可分为随意肌(骨骼肌)和非随意肌(心肌和平滑肌),前者受躯体运动神经的支配和控制,后者则受自主神经的调控。
一、横纹肌
尽管骨骼肌和心肌都属于横纹肌,但心肌(见第四章)属于非随意肌,骨骼肌属于随意肌。
骨骼肌的收缩需在中枢神经系统控制下完成,并依赖于神经-肌接头处的兴奋传递、兴奋-收缩耦联、收缩蛋白的横桥周期等多个亚细胞生物网络系统的协调活动。
(一)骨骼肌神经-肌接头处的兴奋传递
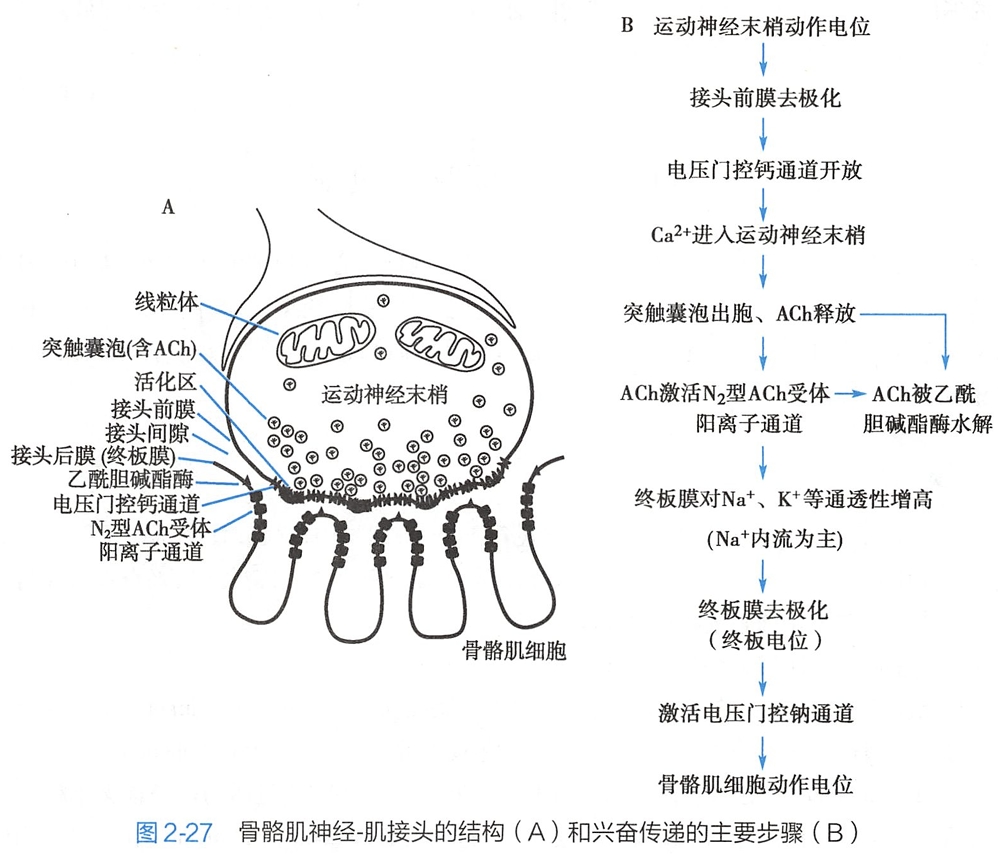
1.骨骼肌神经-肌接头的结构特征
骨骼肌神经-肌接头(neuromuscular junction)是运动神经末梢与其所支配的骨骼肌细胞之间的特化结构,由接头前膜(prejunctional membrane)、接头后膜(postjunctional membrane)和接头间隙(junctional cleft)构成。
接头前膜是运动神经轴突末梢膜的一部分。接头前膜内侧的轴浆中含突触囊泡(synaptic vesicle)或突触小泡,每个囊泡内含乙酰胆碱(acetylcholine,ACh)分子。
接头间隙是接头前膜与接头后膜之间20~30nm的间隔,充满细胞外液。
接头后膜是与接头前膜相对的骨骼肌细胞膜,也称为终板膜(end-plate membrane),呈向内凹陷的浅槽。运动神经纤维在到达末梢处失去髓鞘,以裸露的轴突末梢嵌入终板膜浅槽中。槽底部终板膜又向内凹陷,形成许多皱褶以增大其表面积。
接头后膜上含有N2型ACh受体阳离子通道(N2-ACh receptor cation channel),集中分布于皱褶的开口处(图2-27A)。在接头后膜外表面还分布有乙酰胆碱酯酶(acetylcholinesterase),它能将ACh分解为胆碱和乙酸。
2.骨骼肌神经-肌接头的兴奋传递过程
骨骼肌神经-肌接头的兴奋传递过程如图2-27B所示,具有电-化学电传递的特点:即由运动神经纤维传到轴突末梢的动作电位(电信号)触发接头前膜 Ca2+依赖性突触囊泡出胞,释放ACh至接头间隙(化学信号),再由ACh激活终板膜中N2型ACh受体阳离子通道而产生膜电位变化(电信号)。
N2型ACh受体阳离子通道直径约0.65nm,可允许Na+、K+和Ca2+跨膜移动,但主要是Na+内流和K+外流;在静息状态下,Na+内向驱动力大于K+外向驱动力(见本章第三节),故以Na+内流为主。(因为静息时对Na+通透性更低,导致静息电位偏向K+的平衡电位,所以静息状态下Na+的电化学驱动力会更大)
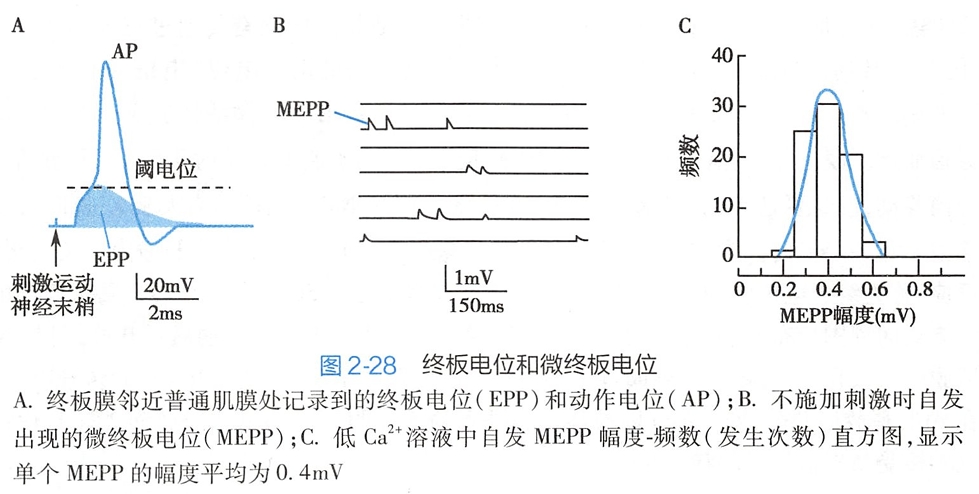
Na+的净内流使终板膜发生去极化反应,称为终板电位(end-plate potential,EPP),其幅度可达50~75mV。EPP属于局部电位,可以电紧张方式向周围扩布,刺激邻近的普通肌膜(非终板膜)中的电压门控钠通道开放,引起Na+内流和普通肌膜的去极化;当去极化达到阈电位水平时即可爆发动作电位(图2-28A),并传导至整个肌细胞膜。
在ACh释放后几毫秒内,ACh即被终板膜外侧的乙酰胆碱酯酶迅速分解而消除其作用,使终板膜恢复到接受新兴奋传递的状态。
在骨骼肌神经-肌接头的兴奋传递过程中,ACh的释放是一个关键性步骤。首先,接头前膜的 ACh释放具有Ca2+依赖性。接头前膜产生的动作电位通过激活前膜中的电压门控钙通道,导致Ca2+内流而触发囊泡的出胞,故细胞外Ca2+浓度的改变可以明显影响兴奋的传递。
其次,运动神经末梢释放ACh是一种量子释放(quantal release),即ACh的释放是以囊泡为基本单位进行的。一个囊泡被称为一个“量子”,释放时囊泡内的ACh倾囊而出。
在静息状态下,因囊泡的随机运动也会发生单个囊泡的自发释放,并引起终板膜电位的微弱去极化,称作微终板电位(miniature end-plate potential,MEPP)(图2-28B),其频率平均约1次/秒。每个MEPP的幅度平均仅0.4mV(图2-28C)。所以接头前膜一次兴奋产生的EPP是由大量囊泡同步释放所引起的MEPP发生总和而形成的。
3.各种因素的影响
另外,由于骨骼肌神经-肌接头的兴奋传递中有神经递质的参与,也就易受到各种因素的影响。
首先是使用性增强现象,如冯德培首次在猫的神经-肌接头部位发现的强直刺激后EPP可持续增大数分钟的现象,被称为强直后增强(post-tetanic potentiation,PTP)。
其次是药物和病理因素的影响,如筒箭毒碱和α-银环蛇毒可特异性阻断终板膜中的N2型ACh受体阳离子通道而松弛肌肉;机体产生自身抗体破坏N2型ACh受体阳离子通道可导致重症肌无力,新斯的明可抑制乙酰胆碱酯酶而改善肌无力患者的症状;有机磷农药中毒却因胆碱酯酶被磷酸化丧失活性而引起中毒症状等。
(二)横纹肌细胞的结构特征
横纹肌细胞的结构特征是细胞内含有大量的肌原纤维和高度发达的肌管系统。
1.肌原纤维和肌节
横纹肌细胞内含有上千条直径1~2nm、纵向平行排列的肌原纤维,在光镜下沿长轴可见明暗交替的横纹,分别称为明带和暗带。
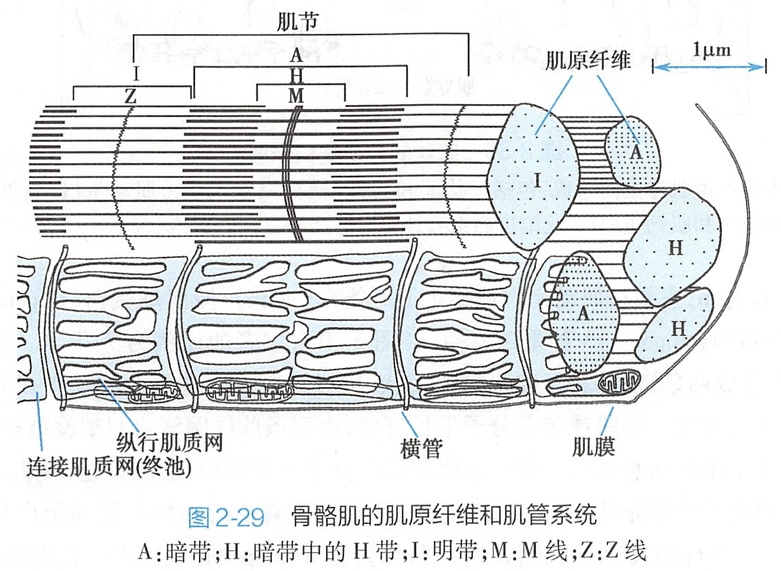
在暗带的中央有一条横向的线,称为M线,M线两侧有相对较亮的区域称为H带;在明带的中央也有一条横线,称为Z线(立体看为Z盘)。相邻两Z线之间的区段称为肌节(sarcomere),是肌肉收缩和舒张的基本单位。
肌原纤维由粗肌丝和细肌丝构成,正是由于粗、细肌丝在肌节中的规则排列,才呈现明带和暗带交替的横纹(图2-29)。
2.肌管系统
横纹肌细胞中有横管和纵管两种肌管系统(图2-29)。
- 横管又称T管(T tubule),是与肌原纤维走行方向垂直的膜性管道,由横纹肌细胞膜内陷并向深部延伸而成。
- 纵管也称L管(L tubule),是与肌原纤维走行方向平行的膜性管道,即肌质网(sarcoplasmic reticulum,SR),
- 其中在肌原纤维周围包绕、交织成网的称为纵行肌质网(longitudinal SR,LSR),其膜上有钙泵,可逆浓度梯度将胞质中Ca2+转运至SR内;
- SR与T管膜或肌膜(见于心肌)相接触的末端膨大或呈扁平状,称为连接肌质网(junctional SR,JSR)或终池(termiNa+l cisterNa+)。JSR内的Ca2+浓度约比胞质中高近万倍。JSR膜中嵌有钙释放通道(calcium release channel)或称雷诺丁受体(ryanodine receptor,RYR),其分布与T管膜或肌膜上的L型钙通道(L-type calcium channel)相对应。
在骨骼肌,T管与其两侧的终池形成三联管(triad)结构;在心肌,T管与单侧的终池相接触形成二联管(diad)结构,都是兴奋-收缩耦联的关键部位。 #?
(三)横纹肌细胞的收缩机制
横纹肌的收缩机制一般用肌丝滑行理论(myofilament sliding theory)来解释,即横纹肌的肌原纤维由与其走向平行的粗肌丝和细肌丝构成,肌肉的缩短和伸长系粗肌丝与细肌丝在肌节内发生相互滑行所致,而粗肌丝和细肌丝本身的长度均不改变。
1.肌丝的分子结构
粗肌丝主要由数百个肌球蛋白或称为肌凝蛋白(myosin)分子聚合而成,单个肌球蛋白分子呈豆芽状,有一个杆部和两个球形的头部,由6条肽链构成。
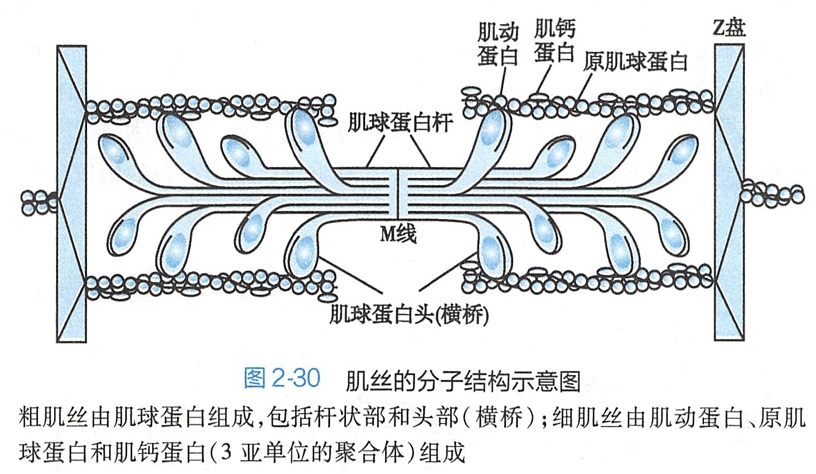
两条重链组成杆状部(粗肌丝的主干),两条重链的头端各结合一对轻链而构成头部,头部连同与它相连的一小段称为“桥臂”的杆状部从肌丝中向外伸出而形成横桥(cross-bridge)(图2-30)。在粗肌丝中,肌球蛋白杆状部集合在一起,且都以尾端朝向暗带中央的M线排列,形成粗肌丝的主干。一般每条粗肌丝上伸出的横桥有300~400个,近M线端约0.2μm没有横桥。横桥具有ATP酶活性,并能与肌动蛋白结合。横桥被激活后可向M线方向扭动,成为肌丝滑行的动力来源。
细肌丝长约1.Oum,主要由肌动蛋白或称为肌纤蛋白(actin)、原肌球蛋白(tropomyosin,或称为原肌凝蛋白)和肌钙蛋白(troponin)3种蛋白质构成(图2-30),三者的比例为7:1:1。肌动蛋白单体为球形分子,通过聚合成两条链,并相互缠绕成螺旋状,构成细肌丝的主干。肌动蛋白分子上有多个能与粗肌丝横桥结合的位点。原肌球蛋白分子呈长杆状,由两条肽链缠绕成双螺旋结构,其长度相当于肌动蛋白中连续7个单体的总长度。多个原肌球蛋白分子首尾相接,形成长链,沿肌动蛋白双螺旋的浅沟旁走行。当肌肉处于舒张状态时,原肌球蛋白所在的位置恰好能掩盖肌动蛋白分子上的横桥结合位点,抑制了肌丝滑行的发生。肌钙蛋白由肌钙蛋白T(troponin T,TnT)、肌钙蛋白I(troponin I, TnI)和肌钙蛋白C(troponin C,TnC)3个亚单位构成,并以一定的间距(7个肌动蛋白单体的长度)出现在原肌球蛋白的双螺旋结构上,即与原肌球蛋白分子以1:1的比例相结合。在肌肉舒张时,TT与 TI分别与原肌球蛋白和肌动蛋白紧密相连,将原肌球蛋白保持在遮盖肌动蛋白上横桥结合位点的位置。TnC上有Ca2+2结合位点,每分子TnC可结合4个Ca2+2+,在胞质中Ca2+2浓度升高时,Ca2+2与TnC结合而导致肌钙蛋白发生构象变化,进而引起TI与肌动蛋白的结合减弱、原肌球蛋白分子向肌动蛋白双螺旋沟槽的深部移动,暴露出肌动蛋白上的横桥结合位点,引发横桥与之结合,产生肌丝滑行而收缩。鉴于肌球蛋白和肌动蛋白直接参与肌肉收缩,故称为收缩蛋白(contractile protein);而原肌球蛋白和肌钙蛋白不直接参与肌肉收缩,但可调控收缩蛋白间的相互作用,故称为调节蛋白(regulatory protein)。
2.肌丝滑行的过程
粗肌丝与细肌丝间的相互滑行,是通过横桥周期(cross-bridge cycling)完成的。横桥周期是指肌球蛋白的横桥与肌动蛋白结合、扭动、复位的过程(图2-31):①在舒张状态下,横桥的ATP酶活性分解与之结合的ATP产生能量使上次扭动过的横桥复位,横桥同时与ADP和磷酸结合而处于高势能和高亲和力状态;②胞质中浓度升高的C2+触发横桥与肌动蛋白结合;③横桥构象改变使其头部向桥臂方向扭动45度,产生“棘齿作用”(ratchet action)而拖动细肌丝向M线方向滑行,横桥储存的势能转变为克服负荷的张力和(或)肌节长度的缩短,同时与横桥结合的ADP和无机磷酸被解离;④横桥再与ATP结合导致亲和力降低而与肌动蛋白分离,重复上述过程。一个横桥周期所需时间为20~200毫秒,其中横桥与肌动蛋白结合的时间约占一半。若胞质中的C2+浓度降低则横桥周期停止司
3.横桥周期的运转模式与肌肉收缩的表现
通过横桥周期完成肌丝滑行而实现肌肉的收缩,实质上是通过肌动蛋白与肌球蛋白的相互作用,将分解ATP获得的化学能转变为机械能的过程。若肌肉在保持长度不变的条件下进行收缩,由于横桥头部与杆状部之间的桥臂具有弹性,横桥的扭动可使桥臂被拉长,借其弹性回缩而产生张力(肌丝不滑行)。若产生的张力能克服阻力而发生肌丝滑行,则表现肌肉缩短(肌丝滑行)。肌肉收缩所能产生的张力由每一瞬间与肌动蛋白结合的横桥数决定,而肌肉缩短的速度则取决于横桥周期的长短。
(四)横纹肌细胞的兴奋-收缩耦联
将横纹肌细胞产生动作电位的电兴奋过程与肌丝滑行的机械收缩联系起来的中介机制,称为兴奋-收缩耦联(excitation-contraction coupling)。Ca2+2是重要的耦联因子,兴奋-收缩耦联的发生部位在骨骼肌的三联管结构或心肌的二联管结构。 1.横纹肌细胞的电兴奋过程骨骼肌细胞的动作电位,是在约-90V的静息电位基础上产生的,其电位变化与神经纤维动作电位相似,也呈尖峰样,持续时间稍长(2~4毫秒),其形成机制亦与神经纤维的动作电位相同。心肌细胞的动作电位依细胞类型不同而异,其特征详见第四章。 2.兴奋-收缩耦联的基本步骤在横纹肌,由肌膜上的动作电位引发的收缩,涉及如下基本步骤:①T管膜的动作电位传导:肌膜上的动作电位沿T管膜传至肌细胞内部,并激活T管膜和肌膜中的L型钙通道。②JSR内Ca2+2+的释放:肌膜的去极化,在骨骼肌可通过构象变化触发钙释放机制(图2- 32A),在心肌则通过钙诱导钙释放(Ca2+lcium-induced Ca2+lcium release,CICR)机制(图2-32B),使JSR内的Ca2+2+顺浓度差释放到胞质中,胞质内的Ca2+2浓度由静息时的0.1umol/L水平迅速升高百倍以上。③Ca2+2+触发肌丝滑行:胞质内Ca2+2+浓度的升高促使Ca2+2+与TnC结合而触发肌肉收缩。④JSR回摄 Ca2+2+:在骨骼肌,胞质内增加的Ca2+2+几乎全部经激活LSR膜中的钙泵而被回摄进SR中,而心肌胞质内的Ca2+2+大部分经LSR膜中的钙泵活动被回收,尚有10%~20%的Ca2+2+则由肌膜中的Na+-Ca2+2交换体和钙泵排至胞外。胞质中C浓度降低则导致肌肉舒张,可见肌肉舒张的过程亦耗能。(五)影响横纹肌收缩效能的因素肌肉收缩效能(performance of contraction)是指肌肉收缩时产生的张力大小、缩短程度,以及产生张力或缩短的速度。根据肌肉收缩的这些外在表现,可将收缩分为等长收缩(isometric contraction)和等张收缩(isotonic contraction)两种形式,前者表现为肌肉收缩时长度保持不变而只有张力的增加;后者表现为肌肉收缩时张力保持不变而只发生肌肉缩短。最常见的收缩形式是先等长收缩增加张力,当张力足以克服阻力时,发生等张收缩而肌肉缩短。影响横纹肌收缩效能的因素包括负荷、肌肉收缩能力及收缩的总和等。
1.前负荷
前负荷(preload)是指肌肉在收缩前所承受的负荷。由于前负荷即为牵拉肌肉的力量,前负荷越大肌肉就被拉得越长,因而前负荷决定肌肉在收缩前的长度,即初长度(initial length),此时因肌肉受到牵拉而弹性回位的张力属于被动张力。通常可将前负荷与初长度看成同义词,在肌肉收缩实验中常用初长度来表示前负荷。例如,在等长收缩实验中,可测定不同初长度条件下肌肉主动收缩产生的张力(即主动张力),对应作图即得到长度-张力关系曲线(length-tension relationship cuv)(图2-33A)。从图中可见,在一定范围内肌肉收缩张力(即主动张力)随初长度的增加而增大,但过度增加初长度则收缩张力下降,表明肌肉收缩存在一个最适初长度(optimal initial length),即产生最大收缩张力的初长度。肌肉初长度对收缩张力的影响与肌节长度的变化有关,如图2-33B所示与最适初长度相对应的肌节长度为2.0~2.2m,此时不仅全部横桥都能发挥作用,而且肌丝间的相互关系也最适合于横桥的活动,故能产生最大的收缩张力。在整体情况下,肌肉一般都处于最适初长度状态,以利于产生最大的收缩张力。
2.后负荷
后负荷(afterload)是指肌肉在收缩后所承受的负荷。由于肌肉在等张收缩时产生的收缩张力与后负荷大小相等,方向相反,故在数值上可用后负荷反映收缩张力的大小。通过测定不同后负荷(张力)时肌肉缩短的速度,对应作图即可得到张力-速度关系曲线(force-velocity relationship curve)(图2-34A),表明后负荷增大时肌肉收缩张力和速度呈反变关系,这是由于后负荷对横桥周期的影响所致(图2-34B)。后负荷在理论上为零时肌肉缩短速度最大,称为最大缩短速度(V),表现为等张收缩;随着后负荷的增大,表现为先等长收缩后等张收缩;当后负荷增加到使肌肉不能缩短时,肌肉产生的张力达到最大,称为最大收缩张力(P。),表现为等长收缩。
3.肌肉收缩能力
肌肉收缩能力(contractility)是指与前负荷和后负荷无关,又能影响肌肉收缩效能的肌肉内在特性。前述前负荷和后负荷对收缩效能的影响,都是在一定肌肉收缩能力(内在因素)条件下,外加因素的作用。当肌肉收缩能力改变时,前负荷和后负荷的影响也将发生变化,如肌肉收缩能力提高可导致长度-张力关系曲线上移、张力-速度关系曲线右上移。由于肌肉收缩能力涉及多方面与肌肉收缩相关的内在因素,可以看作是除与前、后负荷相关因素外,肌肉内在结构和功能特性的总和,如兴奋-收缩耦联过程中胞质内C2+浓度的变化、与肌丝滑行有关的横桥ATP酶活性、肌细胞能量代谢水平、各种功能蛋白及其亚型的表达水平以及肌原纤维的肥大与否等。更为重要的是,机体的神经和体液调节系统、一些致病因素和治疗药物也可通过影响这些内在特性,调节肌肉收缩能力,这在心肌要比在骨骼肌具有更重要的生理意义(见第四章)。
4.收缩的总和
收缩的总和(summation)是指肌细胞收缩的叠加特性,是骨骼肌快速调节其收缩效能的主要方式,其中空间总和形式称为多纤维总和,时间总和形式称为频率总和。不过,心脏的收缩为全或无式的,不会发生心肌收缩的总和(见第四章)。另外,由于骨骼肌是随意肌,其收缩的总和实质上是中枢神经系统调节骨骼肌收缩效能的方式。
多纤维总和(multiple fiber summation)原指多根肌纤维同步收缩产生的叠加效应。但在整体情况下,骨骼肌都以一个运动神经元及其轴突分支所支配的全部肌纤维所构成的运动单位(motor unit)为基本单位进行收缩,其叠加效应通常是参与同步收缩运动单位数目的增加,故又称为多运动单位总和。运动单位有大小之分,且大小相差很大(详见第十章)。由于运动单位的总和依照一定的规律进行,即当收缩逐渐增强时,先增加小的再增加大的运动单位收缩;而当舒张时,先最大的最后最小的运动单位停止收缩,这种调节收缩强度的方式即称为大小原则(size principle)。这种方式不仅能有效地实现收缩强度的调控,也有利于精细活动的调节,因为收缩强度较弱时参与收缩的运动单位较少也较小,调节就比较灵活。频率总和(frequency summation)是指提高骨骼肌收缩频率而产生的叠加效应,这是运动神经元通过改变冲动发放频率调节骨骼肌收缩形式和效能的一种方式。当动作电位频率很低时,每次动作电位之后出现一次完整的收缩和舒张过程,这种收缩形式称为单收缩(twitch)。由于完成一次收缩过程需要的时间远长于动作电位的时间,故动作电位频率增加到一定程度时,后一动作电位所触发的收缩就可叠加于前一次收缩,产生收缩的总和。若后一次收缩过程叠加在前一次收缩过程的舒张期,所产生的收缩总和称为不完全强直收缩(incomplete tetanus);若后一次收缩过程叠加在前一次收缩过程的收缩期,所产生的收缩总和则称为完全强直收缩(complete tetanus)(图2-35A)。在等长收缩条件下,完全强直收缩所产生的张力可达单收缩的3~4倍。这是因为肌细胞动作电位的高频发放能使胞质中C2浓度持续升高,一方面可保证收缩蛋白的充分活化并产生最大张力,另一方面能有效克服肌肉组织的弹性缓冲而表达出稳定的最大收缩张力(图2-35B)。在整体生理情况下,骨骼肌的收缩几乎都以完全强直收缩的形式进行,有利于完成各种躯体运动和对外界物体做功。即使在静息状态下,运动神经也经常发放较低频率的冲动,使骨骼肌进行一定程度的强直收缩,这种微弱而持续的收缩即为肌紧张(见第十章)。
二、平滑肌
平滑肌是构成气道、消化道、血管、泌尿生殖器等器官的主要组织成分,这些器官不仅依赖平滑肌的紧张性收缩来对抗重力或外加负荷,保持器官的正常形态,而且借助于平滑肌收缩而实现其运动功能。平滑肌属于非随意肌,其舒缩活动受自主神经的调控。平滑肌在细胞结构和收缩机制等方面与横纹肌有明显差别。
(一)平滑肌的分类
根据平滑肌细胞之间的相互关系和功能活动特征,通常将平滑肌分为单个单位平滑肌和多单位平滑肌两类。单个单位平滑肌(single-unit smooth muscle)又称内脏平滑肌(visceral smooth muscle),如小血管、消化道、输尿管和子宫等器官的平滑肌,这类平滑肌的肌细胞之间的联系类似于心肌细胞间的闰盘连接(见第四章),存在大量缝隙连接,一个肌细胞的电活动可直接传导到其他肌细胞,这样,平滑肌中全部肌细胞作为一个整体进行舒缩活动,即所谓的功能合胞体样活动。另外,这类平滑肌中还有少数起搏细胞(pacemaK+er cell),它们能自发地产生节律性兴奋和舒缩活动,即具有自动节律性或自律性(autorhythmicity),并能引发整块平滑肌的电活动和机械收缩活动。多单位平滑肌(multi-unit smooth muscle)主要包括睫状肌、虹膜肌、竖毛肌以及气道和大血管的平滑肌等。这类平滑肌的肌细胞之间几乎不含缝隙连接,各自独立,以单个肌细胞为单位进行活动,类似于骨骼肌。这类平滑肌没有自律性,其收缩活动受自主神经的控制,收缩强度取决于被激活的肌纤维数目(空间总和)和神经冲动的频率(时间总和)。
(二)平滑肌细胞的结构特点
平滑肌细胞呈细长纺锤形,长20~500um,直径1~5um。与横纹肌相比,平滑肌细胞内的细肌丝数量明显多于粗肌丝,其比值为(10~15):1(在横纹肌为2:1)。尽管粗肌丝和细肌丝保持互相平行和有序的排列,但无肌节结构,故不显横纹。平滑肌细胞内没有Z盘,相应的功能结构是致密体(dense body)和附着于细胞膜的致密斑,为细肌丝提供附着点并传递张力(图2-36A)。平滑肌细胞内的中间丝,则把致密体和致密斑连接起来,形成细胞的结构网架。平滑肌细胞的粗肌丝结构也不同于横纹肌,以相反的方向在不同方位上伸出横桥,这不仅可使不同方位的细肌丝相向滑行,更可使粗肌丝和细肌丝之间的滑行范围延伸到细肌丝全长(图2-36B),因而具有更大的舒缩范围。平滑肌细胞间有两种连接结构,致密带(指相邻两细胞膜以致密斑对接的部位)为机械连接,缝隙连接为电耦联。平滑肌的细胞膜形成一些纵向走行的袋状凹入,以增加细胞膜的表面积,但没有内陷的T管,故细胞膜上的动作电位不能迅速到达深部,这可能是平滑肌收缩缓慢的原因之一。尽管平滑肌细胞的SR不发达,但SR膜上除存在对 Ca2+2+敏感的RYR外,还存在对P,敏感的IP3R,两者均发挥Ca2+2+释放通道的作用。
(三)平滑肌细胞的生物电现象
平滑肌细胞的静息电位低于横纹肌,在-50~-60mV之间,主要是由于平滑肌细胞膜对Na+的通透性相对较高所致。单个单位平滑肌的静息电位不稳定,可出现缓慢的自发节律性波动,称为慢波(见第六章),周期为数秒至数分钟。
平滑肌细胞的动作电位依平滑肌的类型和部位而异,如肠道和输精管平滑肌细胞的动作电位去极相主要依赖于Ca2+2内流,而膀胱和输尿管平滑肌细胞则以Na+内流为主。动作电位复极相则依赖于K+外流。平滑肌细胞动作电位的时程约为骨骼肌细胞的5~10倍,达10~50毫秒。
(四)平滑肌细胞的收缩机制
1.平滑肌收缩的触发因子
与横纹肌相同,平滑肌细胞收缩的触发因子也是Ca2+2,但平滑肌细胞胞质中Ca2+2浓度的调控存在电-机械耦联和药物-机械耦联两条途径。电-机械耦联(electromechaniCa2+l coupling)是指平滑肌细胞先在化学信号或牵张刺激作用下产生动作电位,再通过兴奋-收缩耦联过程升高胞质中Ca2+2+浓度,但Ca2+2+主要来源于细胞外,即Ca2+2+从细胞膜中电压门控通道或机械门控通道流入胞内,仅小部分Ca2+2+来自SR通过RYR释放。药物-机械耦联(pharmacomechaniCa2+l coupling)是指在不产生动作电位的情况下,通过接受化学信号而直接诱发胞质中C2+浓度的升高。胞外化学信号可通过激活G蛋白耦联受体-PLC-IP,通路而生成IP,,IP,再激活SR膜中的IP,R,介导SR内Ca2++释放到胞质内,导致胞质内Ca2+2+浓度升高。在平滑肌舒张过程中,胞质内Ca2+2的下降则依靠SR膜中钙泵活动将Ca2+2+回摄入SR,以及细胞膜中Na+*-Ca2+2+交换体和钙泵将Ca2+2转运出细胞,这一过程要比骨骼肌缓慢,这可能是平滑肌舒张相对缓慢的原因之一。
2.平滑肌细胞的肌丝滑行
平滑肌细胞内不含肌钙蛋白,而有钙调蛋白(CM),故胞质中Ca2+2+主要通过Ca2+2+-Ca2+M通路作用于粗肌丝而触发收缩。平滑肌粗肌丝的横桥受磷酸化调节,在静息状态下横桥头部的ATP酶活性很低,而肌球蛋白轻链(myosin light chain,MLC)的磷酸化可提高横桥ATP酶活性,并引发肌丝滑行和肌肉收缩。在多数平滑肌细胞,胞质中浓度升高的Ca2+2+与CM结合形成 Ca2+2+-Ca2+M复合物,后者活化胞质中的肌球蛋白轻链激酶(myosin light chain K+iNa+se,MLCK+),活化的 MLCK+进一步使横桥中一对20K+D的MLC磷酸化,从而触发平滑肌细胞收缩。反之,当胞质中C2浓度降低时,MLCK+失活,而磷酸化的MLC在胞质中肌球蛋白轻链磷酸酶(MLC phosphatase,MLCP)的作用下去磷酸化,导致平滑肌细胞舒张。
(五)平滑肌活动的神经调节
作为非随意肌,大多数器官的平滑肌接受交感和副交感神经的双重支配,且神经的兴奋通过非定向突触传递方式传递到平滑肌细胞(见第十章),作用比较弥散、缓慢,除兴奋作用外,也有抑制作用。对于内脏平滑肌,自主神经的活动主要是调节其兴奋性和收缩的强度与频率,而对多单位平滑肌,通常由自主神经直接控制其收缩活动。